Меню сайта
- На главную
- Рост растений
- Почвенные простейшие
- Полиморфизмы
- Дыхание бактерий
- Органическая природа
- Первая жизньу
- Материалы по биологии
Последние новости
Причина отравления вод океана.
Американские ученые из штата Мичиган полагают, что в качестве главной причины отравления вод Мирового океана ртутью являются бактерии.
Секрет выживания лягушек.
Американским ученым удалось выяснить, как лягушкам удается продолжать жить даже после глубокой заморозки.
Секрет долголетия ночницы.
Биологи уже давно считают, что продолжительность жизни животного определяется очень просто: чем оно больше, тем дольше живет.
Работа системы фибринолизаМатериалы по биологии и химии / Экспериментальное исследование активации системы свертывания ферментами фибринолиза / Работа системы фибринолиза
Расщепление фибрина плазмином − ключевая реакция фибринолиза, физиологической ролью которого является растворение фибриновых сгустков крови, образующихся в результате работы системы свертывания. Сгустки представляют собой скопление клеток крови, переплетенное сетью полимеризованного белка фибрина. Фибриновая часть сгустка формируется следующим образом. Сериновая протеаза тромбин активирует белок фибриноген, отщепляя от него отрицательно заряженные фибринопептиды A и B и образуя при этом активный мономер фибрина размерами 45нм x 2нм.
Такие мономеры быстро полимеризуются между собой в длинные двухцепочечные нити (протофибриллы) ,радиусом 3-5 нм [2], [37]. Образовавшиеся протофибриллы впоследствии собираются в более крупные структуры − фибриллы, которые и составляют сеть сгустка [2]. Параметры сгустка зависят от условий полимеризации: концентраций тромбина и фибриногена, ионной силы раствора [37]. Образовавшиеся фибриллы имеют относительно постоянный диаметр по всему объему сгустка и могут ветвиться [38]. При физиологических условиях диаметр фибрилл может составлять 50-100 нм [38]. Суть фибринолиза заключается в расщеплении фибриновых волокон. Такое расщепление способен делать плазмин, являющийся сериновой протеазой и циркулирующий в крови в виде своего неактивного предшественника плазминогена. Превращение плазминогена в плазмин происходит под действием специфических активаторов [39].
Появление фибрина в плазме вызывает изменение скорости активации плазминогена с помощью ТПА на 3 порядка [24], тем самым инициируя запуск фибринолиза. Активный центр плазмина содержит аминокислотные остатки, типичные для сериновых протеаз (His 602, Asp 645, Ser 740), в то время как лизин-связывающие участки, входящие в состав пяти крингл-доменов плазмина обеспечивают взаимодействие фермента с фибрином, фибриногеном и α2-антиплазмином [39], поэтому связанный с фибрином плазмин гораздо хуже ингибируется антиплазмином [2], что является очень важным физиологическим эффектом, т.к. в данном случае активация системы фибринолиза происходит только в области наличия сгустка. На каждом мономере фибрина находятся два сайта связывания плазмина [40] (рис. 3), хотя в процессе деградации появляются дополнительные центры связывания на С-концевых остатках лизина расщепленных цепей фибрина [41]. В результате лизиса от фибрина отщепляются продукты деградации разных размеров и массы [42].
Таким образом процесс фибринолиза можно разделить на две основные фазы: образование фибрина в котором открываются сайты связывания для ТПА и плазминогена, тем самым запуская фибринолиз, и разрушение фибриновых нитей, при котором открываются новые сайты связывания плазмина (C-концевые лизиновые остатки) [43].
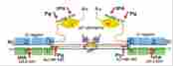
Рис.3. Сайты связывания плазминогена, ТПА и фибрина [2]. Аα, Bβ и γ цепи представлены оранжевым, синим и зеленым цветом соответственно. Аα392-610 - область связывания как плазминогена, так и ТПА. γ312-324 - сайт связывания ТПА, Аα148-160 - сайт связывания плазминогена.
В первой фазе так же происходит изменение конформации активаторов плазминогена т.к. появившийся плазмин превращает одноцепочечнуые конформации ТПА и УПА в двухцепочечные путем разрезания связи Арг275-Иле276 и Лиз158-Иле159 соответственно (рис.4). Двухцепочечная урокиназа имеет в 250 раз большую активность по отношению к плазмину, нежели одноцепочечная [19]. В то же время, двухцепочечная форма урокиназы становится подвержены ингибированию с помощью ПАИ [44]. Для ТПА же ингибирование ПАИ характерно как для двухцепочечной, так и для одноцепочечной формы [45], константы ингибирования представлены в таблице 1 .
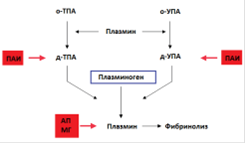
Рис.4. Схема ингибирования системы фибринолиза.
Таблица 1. Константы ингибирования второго порядка [10^7/М/с] ТПА и УПА с помощью ПАИ-1 [45]
|
о-ТПА |
д-ТПА |
УПА | |
|
ПАИ-1 |
1 |
3 |
5 |
Смотрите также
Роль биологических мотиваций в поведении
Введение
Термин "мотивация"
имеет латинский корень movere - двигать. Зоологи, наблюдая за поведением
животных в природе, также выдвинули предположение о существовании механи ...
Острое и хроническое отравление алкоголем, его влияние на адаптивные процессы организма
Введение
Алкогольные
напитки - это напитки, содержащие этанол (этиловый спирт, алкоголь).
В
нашей стране ежегодно употребляется до 9,67 литра абсолютного алкоголя на душу
населени ...
Крионика - "холодная" наука
Введение
Фантастические
представления о волшебном сне, который длится много лет и после которого
человек возвращается к жизни, не постарев, нашли отражение в трудах философов,
писате ...