Меню сайта
- На главную
- Рост растений
- Почвенные простейшие
- Полиморфизмы
- Дыхание бактерий
- Органическая природа
- Первая жизньу
- Материалы по биологии
Последние новости
Причина отравления вод океана.
Американские ученые из штата Мичиган полагают, что в качестве главной причины отравления вод Мирового океана ртутью являются бактерии.
Секрет выживания лягушек.
Американским ученым удалось выяснить, как лягушкам удается продолжать жить даже после глубокой заморозки.
Секрет долголетия ночницы.
Биологи уже давно считают, что продолжительность жизни животного определяется очень просто: чем оно больше, тем дольше живет.
Модели протекания апоптозаМатериалы по биологии и химии / Роль митохондрий в апоптозе / Модели протекания апоптоза
На поверхности каждой клетки имеются «смертельные рецепторы», способные улавливать апоптические сигналы. Многие сигналы смерти поступают на митохондрию посредством белков семейства Bcl-2, таких, как белки Bid
и Bad
. Эти белки работают специфически.
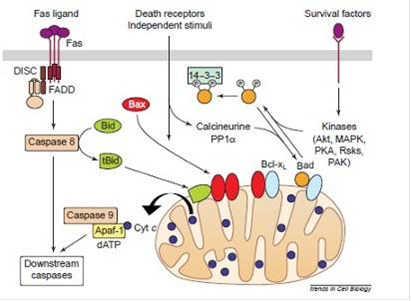
Рисунок 4. Различные механизмы апоптоза
1.В некоторых клетках белок Fas
взаимодействует с трансмембранным белком, запуская тем самым программу смерти, что приводит к тримеризации Fas и формированию вызывающего клеточную смерть комплекса сигналов (DISC
-
death-inducing signaling complex). Этот комплекс так же называют апоптосомой, и он формируется путем объединения цитоплазматической области Fas, белка FADD
и прокаспазы 8, способной к созданию активного фермента - каспазы 8.
Затем, каспаза 8 взаимодействует с белком Bid и расщепляет его до концевого продукта - t-Bid, который, активизирует Bax или Bax-подобные белки, способствующие активизации и выходу цитохрома С (смотри рисунок 5). Bax претерпевает морфологические изменения, олигомеризуется и встраивается во внешнюю мембрану митохондрии. Это способствует быстрому освобождению цитохрома с. Вполне возможно, что Bax вставляется в митохондрию прежде, чем олигомеризуется. Эти события могут быть вызваны посредством взаимодействия Bax с белком Bid или прокаспазой-8 вкупе с белками Bid и tBid, а так же, могут быть подавлены путем прямого взаимодействия Bax с белками Bcl-2 и Bcl-XL. Bax-подобный белок «Bak» активируется через аналогичные механизмы.
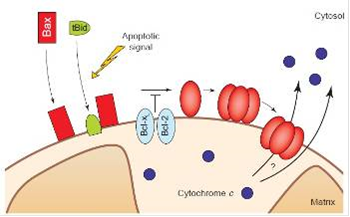
Рисунок 5. Высвобождение цитохрома С белком Bax
Есть, так же, вариант, когда t-Bid может активизировать цитохром С самостоятельно, без взаимодействия с Bax, встраиваясь в мембрану митохондрии и, вкупе с белком - порином, образуя канал проводимости.
После этого, в цитозоле, цитохром С активизирует каспазу 9, путем связывания Apaf-1 с АТФ/дАТФ и прокаспазой 9 (о комплексе которых уже говорилось ранее). После чего идет дальнейшее развитие апоптоза, сопровождающееся образованием новых каспаз и разрушением клетки.
2.Каспаза 8 может так же инициировать сигнальный путь, который не зависит от митохондрии, путем активизирования дальнейшего каскада реакций с образованием новых каспаз.
3.Белки Bad и Bax, перемещаясь по митохондрии, так же могут вызвать апоптоз, получив сигнал независимой от рецепторов смерти. В здоровых клетках Bad фосфорилируется в ответ на присутствие в клетке некоторых каспаз, таких как, Akt, митоген-активирующаяся протеиновая киназа (MAPC), Erk, PKA (протеинкиназа-А), Rsks (MAPK-активизирующаяся киназа) и PAK (p21-активизирующаяся киназа 1). Проще говоря, апоптоз не запускается в ответ на пролиферацию (разрастание) клеток.
Связывание Bad с сильными антиапоптозными белками Bcl-xL и Bcl-2, находящимися на мембране митохондрии, инактивирует последние, что ведет к клеточной гибели. Однако, будучи фосфорилированным, Bad может образовывать комплекс с 14-3-3 белком в цитоплазме, предотвращая тем самым связь Bad с митохондриально локализованными Bcl-xL и Bcl-2 и, таким образом, подавляя апоптоз. Два фосфорилированных сериновых остатка встраиваются в белковую последовательность 14-3-3. Фосфорилирование каждого остатка - как результат изоляции Bad в цитозоле.
4.При апоптозе Bad является дефосфорилированным и перемещается в митохондрии, где связывается с Bcl-xL. Между тем, Bcl-xL замещает Bad на Bax, тем самым подавляя апоптоз.
Если Bcl-2 включает механизм выживания клеток, то Bax ускоряет апоптоз. Bcl-2 и Bax могут образовывать гетеродимеры (причем, в данном случае, способности Bax заглушаются, и клетка выживает). Предполагается, что соотношение белков Bcl-2 и Bax может быть главной клеточной способностью к апоптозу. (центральный рисунок).
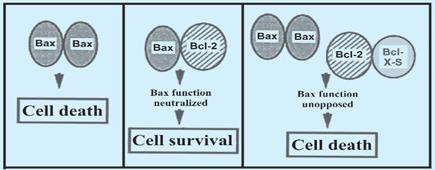
Рисунок 6.
Комбинации гетеродимеров, усиливающих и подавляющих апоптоз
Гетеродимер Bax + Bax способствуют клеточной смерти (рисунок слева) так же, как и комплекс Bcl-2 + Bcl-xs (рисунок справа).
Для активности, подавляющей смерть, Bcl-2 и Bcl-xL должны сформировать димеры с протеином Вах, в то время как димеры с протеином Bad усиливают смерть.
Смотрите также
Физиология развития ребенка
Введение
К
моменту рождения организм ребенка еще очень далек от зрелого состояния.
Человеческий детеныш рождается маленьким, беспомощным, он не может выжить без
ухода и заботы взросл ...
Клеточный иммунный ответ
Введение
Клеточный
иммунный ответ (cellular immune response) [лат. immunis - свободный,
избавленный от чего-либо] - иммунный ответ организма на появление антигенов,
осуществляемый Т- ...
Концепции общественного развития
Введение
Накопленный
человечеством опыт духовного освоения истории при всем различии мировоззренческих
и методологических позиций обнаруживает некоторые общие черты.
Во-первых,
ис ...